
Periodiske egenskaper til elementer og deres egenskaper

De Periodiske egenskaper til elementene er de som definerer deres fysiske og kjemiske atferd fra et atomperspektiv, og hvis størrelser, i tillegg til atomnummeret, tillater en klassifisering av atomer.
Av alle eiendommene er disse, som navnet antyder, karakterisert som periodiske; det vil si at hvis det periodiske systemet blir studert, vil det være mulig å sertifisere at størrelsesorden følger en trend som sammenfaller og gjentas med rekkefølgen av elementene i perioder (rader) og grupper (kolonner).

For eksempel, hvis en periode blir krysset og en periodisk eiendom synker i størrelse med hvert element, vil det samme skje med det i alle perioder. På den annen side, hvis det å gå ned en gruppe eller kolonne øker størrelsen, kan det forventes at det samme vil skje for de andre gruppene..
Og så blir dens variasjoner gjentatt og viser en enkel tendens som stemmer overens med rekkefølgen av elementene etter deres atomnummer. Disse egenskapene er direkte ansvarlige for den metalliske eller ikke-metalliske karakteren til elementene, samt deres reaktivitet, noe som har bidratt til å klassifisere dem i større dybde..
Hvis elementenes identitet et øyeblikk var ukjent og de ble sett på som rare "kuler", kunne det periodiske systemet gjenoppbygges (med mye arbeid) ved å bruke disse egenskapene..
På denne måten ville de antatte kulene tilegne seg farger som gjør at de kan skilles fra hverandre i grupper (øvre bilde). Når de kjenner deres elektroniske egenskaper, kan de organiseres i perioder, og gruppene vil avsløre de som har samme antall valenselektroner.
Læring og resonnement om periodiske egenskaper er det samme som å vite hvorfor elementer reagerer på en eller annen måte; er å vite hvorfor metallelementer er i visse områder av tabellen, og ikke-metalliske elementer i en annen.
Artikkelindeks
- 1 Hva er de periodiske egenskapene og deres egenskaper
- 1.1 -Atomisk radius
- 1.2 -Elektronegativitet
- 1.3 -Metallkarakter
- 1.4 -Ioniseringsenergi
- 1.5 -Elektronisk affinitet
- 2 Referanser
Hva er de periodiske egenskapene og deres egenskaper
-Atomic radio
Når du observerer kulene i bildet, er det første man kan merke seg at de ikke er like store. Noen er større enn andre. Hvis du ser nærmere på, vil du oppdage at disse størrelsene varierer i henhold til et mønster: i en periode synker den fra venstre til høyre, og i en gruppe øker den fra topp til bunn..
Ovennevnte kan også sies på denne måten: Atomradien synker mot gruppene eller kolonnene til høyre, og øker i de nedre periodene eller radene. Dette er tilfelle, atomeradien er den første periodiske egenskapen, siden dens variasjoner følger et mønster i elementene..
Atomladning mot elektroner
Hvorfor dette mønsteret? I en periode okkuperer atomene på samme energinivå, som er relatert til avstanden som skiller dem fra kjernen. Når vi beveger oss fra en gruppe til en annen (som er det samme som å gå gjennom perioden til høyre), tilfører kjernen både elektroner og protoner innenfor samme energinivå..
Derfor kan ikke elektronene oppta ytterligere avstander fra kjernen, noe som øker den positive ladningen fordi den har flere protoner. Følgelig opplever elektronene en større tiltrekningskraft mot kjernen, og tiltrekker dem mer og mer etter hvert som antall protoner øker..
Derfor har elementene lengst til høyre i det periodiske systemet (gule og turkise kolonner) de minste atomradiene..
På den annen side, når du "hopper" fra en periode til en annen (som er det samme som å si at du går ned en gruppe), tillot de nye energinivåene at elektronene okkuperte fjernere rom fra kjernen. Å være lenger borte tiltrekker kjernen (med flere protoner) dem med mindre kraft; og atomeradiene øker derfor.
Joniske radier
Joniske radier følger et lignende mønster som atomradier; Disse avhenger imidlertid ikke så mye av kjernen, men av hvor mange eller færre elektroner atomet har med hensyn til sin nøytrale tilstand..
Kationene (Na+, ACto+, Til3+, Væreto+, Tro3+) har en positiv ladning fordi de har mistet en eller flere elektroner, og derfor tiltrekker kjernen dem med større kraft siden det er færre frastøt mellom dem. Resultatet: kationer er mindre enn atomene de er avledet fra.
Og for anionene (Oto-, F-, Sto-, Jeg-tvert imot, de utviser negativ ladning fordi de har en eller flere elektroner i overkant, og øker deres frastøt til hverandre over tiltrekningen som kjernen utøver. Resultatet: anionene er større enn atomene de kommer fra (bildet nedenfor).
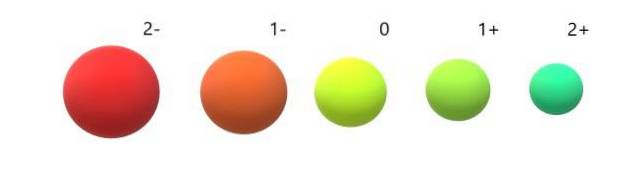
Det er verdsatt at 2-anionen er den mest omfangsrike av alle, og 2+ kationen den minste. Radiene øker når atomet er negativt ladet, og trekker seg sammen når det er positivt ladet..
-Elektronegativitet
Når grunnstoffer har små atomradier, tiltrekkes ikke bare elektronene deres veldig sterkt, men også elektroner fra nærliggende atomer når de danner en kjemisk binding. Denne tendensen til å tiltrekke elektroner fra andre atomer i en forbindelse er kjent som elektronegativitet..
Bare et atom er lite betyr ikke at det vil være mer elektronegativt. I så fall vil elementene helium og hydrogen være de mest elektronegative atomer. Helium, så vidt vitenskapen har vist, danner ikke en kovalent binding av noe slag; og hydrogen, har bare en enkelt proton i kjernen.
Når atomradiene er store, har ikke kjernene nok kraft til å tiltrekke elektroner fra andre atomer; derfor er de mest elektronegative elementene de med en liten atomradius og et større antall protoner.
Igjen, de som oppfyller disse egenskapene perfekt er ikke-metalliske elementer i p-blokken i det periodiske systemet; Dette er de som tilhører gruppe 16 eller oksygen (O, S, Se, Te, Po), og gruppe 17 eller fluor (F, Cl, Br, I, At).
Trend
I henhold til alt som er blitt sagt, ligger de mest elektronegative elementene spesielt i øvre høyre hjørne av det periodiske systemet; med fluor som elementet som leder listen over de mest elektronegative.
Hvorfor? Uten å ty til elektronegativitetsskalaer (Pauling, Mulliken, etc.), selv om fluor er større enn neon (edelgassen i sin periode), kan førstnevnte danne bindinger mens sistnevnte ikke kan. I tillegg, for sin lille størrelse, har kjernen mange protoner, og hvor fluor er, vil det være et dipolmoment.
-Metallisk karakter
Hvis et element har en atomeradius sammenlignet med dem fra samme periode, og heller ikke er veldig elektronegativ, er det et metall og har en høy metallisk karakter.
Hvis vi går tilbake til hovedbildet, tilsvarer de rødlige og grønne kulene, som de grå, metalliske elementer. Metaller har unike egenskaper, og herfra begynner de periodiske egenskapene å flettes sammen med materiens fysiske og makroskopiske egenskaper..
Elementer med høy metallisk karakter er preget av deres relativt store atomer, lett å miste elektroner siden kjernene knapt kan tiltrekke dem til dem..
Som et resultat blir de lett oksidert eller mistet elektroner for å danne kationer, M+; dette betyr ikke at alle kationer er metalliske.
Trend
På dette punktet kan du forutsi hvordan den metalliske karakteren varierer i det periodiske systemet. Hvis det er kjent at metaller har store metalliske radier, og at de også er få elektronegative, bør det forventes at de tyngste elementene (de nedre periodene) er de mest metalliske; og de letteste elementene (de øvre periodene), jo mindre metalliske.
Dessuten avtar metallkarakteren jo mer elektronegativt elementet blir. Dette betyr at ved å gå gjennom periodene og gruppene til høyre for det periodiske systemet, i de øvre periodene, vil de finne de mindre metalliske elementene..
Derfor øker metallkarakteren synkende gjennom en gruppe, og avtar fra venstre til høyre i samme periode. Blant de metalliske elementene vi har: Na (natrium), Li (litium), Mg (magnesium), Ba (barium), Ag (sølv), Au (gull), Po (polonium), Pb (bly), Cd (kadmium ), Al (aluminium) osv.
-Ioniseringsenergi
Hvis et atom har en stor atomradius, kan det forventes at kjernen ikke vil holde elektroner i de ytterste skjellene fanget med betydelig kraft. Derfor vil det ikke kreve mye energi å fjerne dem fra atomet i gassfasen (individualisert); dvs. ioniseringsenergien, EI, som trengs for å fjerne et elektron fra dem.
EI tilsvarer også å si at det er energien som må tilføres for å overvinne den attraktive kraften til et atom eller et gassion på dets ytterste elektron. Jo mindre atom og jo mer elektronegativ, desto lavere er EI; dette er din trend.
Følgende ligning illustrerer et eksempel:
Na (g) => Na+(g) + e-
EI som trengs for å oppnå dette er ikke så bra sammenlignet med den andre ioniseringen:
Na+(g) => Nato+(g) + e-
Siden i Na+ positive ladninger dominerer og ionet er mindre enn det nøytrale atomet. Følgelig kjernen til Na+ tiltrekker seg elektroner med en mye større kraft, og krever en mye større EI.
-Elektronisk tilhørighet
Og til slutt er det den periodiske egenskapen til elektronisk tilhørighet. Dette er den energiske tendensen til atomet til et element i gassfasen til å akseptere et elektron. Hvis atomet er lite og har en kjerne med stor tiltrekningskraft, vil det være lett for det å akseptere elektronet og danne et stabilt anion..
Jo mer stabil anionet er med hensyn til dets nøytrale atom, jo større er elektronaffiniteten. Imidlertid kommer frastøt mellom elektronene i seg selv også inn.
Nitrogen har for eksempel høyere elektronaffinitet enn oksygen. Dette er fordi de tre 2p-elektronene ikke er parret og avviser hverandre og det innkommende elektronet mindre. mens det er oksygen, er det et par sammenkoblede elektroner som utøver større elektronisk frastøting; og i fluor er det to par.
Det er av denne grunn at trenden innen elektroniske tilhørigheter sies å normalisere seg fra tredje periode i det periodiske systemet..
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). CENGAGE Læring.
- Prof. Ortega Graciela M. (1. april 2014). Periodiske egenskaper til elementene. Farge abc. Gjenopprettet fra: abc.com.py
- Kjemi LibreTexts. (7. juni 2017). Elementers periodiske egenskaper. Gjenopprettet fra: chem.libretexts.org
- Helmenstine, Anne Marie, Ph.D. (2. januar 2019). De periodiske egenskapene til elementene. Gjenopprettet fra: thoughtco.com
- Toppr. (s.f.). Periodiske egenskaper av elementer. Gjenopprettet fra: toppr.com /
- Elementernes periodiske egenskaper: En reise over bordet er en reise gjennom kjemi. [PDF]. Gjenopprettet fra: cod.edu



Ingen har kommentert denne artikkelen ennå.