
Hva er den eksterne elektronkonfigurasjonen?

De elektronisk konfigurasjon, Også kalt elektronisk struktur, det er arrangementet av elektroner i energinivåer rundt en atomkjerne. I følge den gamle Bohr-atommodellen opptar elektroner forskjellige nivåer i baner rundt kjernen, fra det første skallet nærmest kjernen, K, til det syvende skallet, Q, som er lengst fra kjernen..
Når det gjelder en mer raffinert kvantemekanisk modell, er K-Q-skjellene delt inn i et sett med orbitaler, som hver kan okkuperes av ikke mer enn ett par elektroner..
Vanligvis brukes elektronkonfigurasjonen til å beskrive orbitalene til et atom i grunntilstand, men det kan også brukes til å representere et atom som har ionisert til et kation eller anion, og kompenserer for tap eller gevinst av elektroner i deres respektive orbitaler. ..
Mange av de fysiske og kjemiske egenskapene til grunnstoffer kan korreleres med deres unike elektroniske konfigurasjoner. Valenselektroner, elektronene i det ytterste skallet, er den avgjørende faktoren for den unike kjemien til elementet..
Grunnleggende om elektronkonfigurasjoner
Før man tilordner elektronene til et atom til orbitaler, bør man gjøre seg kjent med det grunnleggende om elektronkonfigurasjoner. Hvert element i det periodiske systemet består av atomer som består av protoner, nøytroner og elektroner..
Elektroner utviser en negativ ladning og finnes rundt atomkjernen i elektronens orbitaler, definert som volumet av rommet der elektronet kan bli funnet innen 95% sannsynlighet..
De fire forskjellige typer orbitaler (s, p, d og f) har forskjellige former, og en orbital kan inneholde maksimalt to elektroner. P-, d- og f-orbitalene har forskjellige undernivåer, slik at de kan holde flere elektroner.
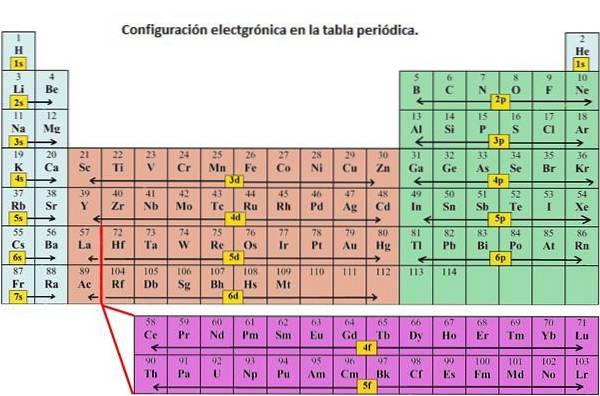
Som angitt, er elektronkonfigurasjonen til hvert element unik for sin posisjon i det periodiske systemet. Energinivået bestemmes av perioden og antall elektroner er gitt av atomnummeret til elementet.
Orbitaler på forskjellige energinivå ligner hverandre, men opptar forskjellige områder i rommet..
1s orbital og 2s orbital har karakteristikkene til en s orbital (radiale noder, sfæriske volum sannsynligheter, de kan bare inneholde to elektroner, etc.). Men fordi de har forskjellige energinivåer, opptar de forskjellige rom rundt kjernen. Hver bane kan representeres av spesifikke blokker i det periodiske systemet..
Blokk s er regionen av alkalimetaller inkludert helium (gruppe 1 og 2), blokk d er overgangsmetaller (gruppe 3 til 12), blokk p er elementene i hovedgruppen til gruppe 13 til 18, og f-blokken er lantanid- og aktinidseriene.

Aufbau-prinsippet
Aufbau kommer fra det tyske ordet "Aufbauen" som betyr "å bygge". I det vesentlige bygger vi elektronorbitaler ved å skrive elektronkonfigurasjoner når vi beveger oss fra ett atom til et annet..
Når vi skriver elektronkonfigurasjonen til et atom, vil vi fylle ut orbitalene i økende rekkefølge av atomnummer.
Aufbau-prinsippet stammer fra Pauli-utelukkelsesprinsippet som sier at det ikke er to fermioner (f.eks. Elektroner) i et atom. De kan ha samme sett med kvantetall, så de må "stable" på høyere energinivå.
Hvordan elektroner akkumuleres er et tema for elektronkonfigurasjoner (Aufbau Principle, 2015).
Stabile atomer har like mange elektroner som protoner har i kjernen. Elektroner samles rundt kjernen i kvanteorbitaler etter fire grunnleggende regler kalt Aufbau-prinsippet..
- Det er ikke to elektroner i atomet som deler de samme fire kvantetallene n, l, m og s.
- Elektroner vil oppta orbitaler med lavest energinivå først.
- Elektronene vil alltid fylle orbitalene med samme spinnnummer. Når orbitalene er fulle, begynner det.
- Elektronene vil fylle orbitaler med summen av kvantetallene n og l. Orbitaler med like verdier på (n + l) fylles først med de lavere n-verdiene.
Andre og fjerde regler er i utgangspunktet de samme. Et eksempel på regel fire vil være 2p og 3s orbitaler.
En 2p-bane er n = 2 og l = 2 og en 3s-bane er n = 3 og l = 1. (N + l) = 4 i begge tilfeller, men 2p-orbitalen har den laveste energien eller den laveste n-verdien og vil fyll før laget 3s.
Heldigvis kan Moeller-diagrammet vist i figur 2 brukes til å gjøre elektronfylling. Grafen leses ved å kjøre diagonalene fra 1s.
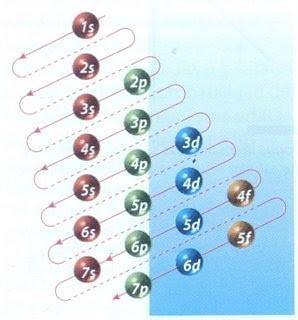
Figur 2 viser atomorbitalene og pilene følger veien videre.
Nå som orbitalenes rekkefølge er kjent for å være fylt, er det eneste som er igjen å huske størrelsen på hver bane.
S-orbitaler har 1 mulig verdi på ml å holde 2 elektroner
P-orbitaler har 3 mulige verdier på ml å holde 6 elektroner
D-orbitaler har 5 mulige verdier på ml å holde 10 elektroner
F-orbitaler har 7 mulige verdier på ml å holde 14 elektroner
Dette er alt som trengs for å bestemme den elektroniske konfigurasjonen av et stabilt atom av et element..
Ta for eksempel elementet nitrogen. Nitrogen har syv protoner og derfor syv elektroner. Den første banen som er fylt er 1-banen.
En s bane har to elektroner, så det er fem elektroner igjen. Neste bane er 2-bane og inneholder de to neste. De tre siste elektronene vil gå til 2p-bane som har plass til opptil seks elektroner (Helmenstine, 2017).
Viktigheten av ekstern elektronkonfigurasjon
Elektronkonfigurasjoner spiller en viktig rolle i å bestemme egenskapene til atomer.
Alle atomene i samme gruppe har samme eksterne elektroniske konfigurasjon med unntak av atomnummeret n, og det er grunnen til at de har lignende kjemiske egenskaper.
Noen av nøkkelfaktorene som påvirker atomegenskapene inkluderer størrelsen på de største okkuperte orbitalene, energien til orbitalene med høyere energi, antall orbitalvakanser og antall elektroner i orbitalene med høyere energi..
De fleste atomegenskaper kan være relatert til graden av tiltrekning mellom de ytterste elektronene til kjernen og antall elektroner i det ytterste elektronskallet, antall valenselektroner.
Elektronene i det ytre skallet er de som kan danne kovalente kjemiske bindinger, de er de som har evnen til å ionisere til å danne kationer eller anioner, og de er de som gir oksidasjonstilstanden til de kjemiske elementene.
De vil også bestemme atomradiusen. Når n blir større, øker atomradiusen. Når et atom mister et elektron, vil det være en sammentrekning av atomradien på grunn av reduksjonen i negativ ladning rundt kjernen..
Elektronene til det ytre skallet er de som blir tatt i betraktning av valensbindingsteori, krystallfeltteori og molekylær orbitalteori for å oppnå molekylenes egenskaper og hybridiseringene av bindingene..
Referanser
- Aufbau-prinsipp. (2015, 3. juni). Hentet fra chem.libretexts: chem.libretexts.org.
- Bozeman Science. (2013, utmattet 4). Elektronkonfigurasjon. Hentet fra youtube: youtube.com.
- Elektronkonfigurasjoner og egenskapene til atomer. (S.F.). Hentet fra oneonta.edu: oneonta.edu.
- Encyclopædia Britannica. (2011, 7. september). Elektronisk konfigurasjon. Hentet fra britannica: britannica.com.
- Faizi, S. (2016, 12. juli). Elektroniske konfigurasjoner. Hentet fra chem.libretexts: chem.libretexts.org.
- Helmenstine, T. (2017, 7. mars). Aufbau-prinsippet - elektronisk struktur og Aufbau-prinsippet. Hentet fra thoughtco: thoughtco.com.
- Khan, S. (2014, 8. juni). Valenselektroner og liming. Hentet fra khanacademy: khanacademy.org.



Ingen har kommentert denne artikkelen ennå.