
Kalsiumsulfid (CaS) struktur, egenskaper, produksjon, bruksområder

De kalsiumsulfid Det er et uorganisk fast stoff dannet av grunnstoffet kalsium (Ca) og grunnstoffet svovel (S), den kjemiske formelen er CaS. Det er et gulhvitt fast stoff som er løselig i vann, funnet i naturen i noen vulkaner og i noen meteoritter i form av et mineral som kalles oldhamitt..
Når CaS oppløses i vann, danner det forskjellige forbindelser på grunn av sulfidionen Sto- blir ion SH- og OH-ioner dannes-. Den resulterende løsningen er alkalisk. Denne forbindelsen brukes som en base for forbindelser som er selvlysende eller som produserer synlig lys under visse forhold. Disse materialene brukes også i lysende maling.

CaS har blitt sett på som et mulig medikament for å behandle hjerte- og blodkarproblemer som hypertensjon eller høyt blodtrykk, som er en sykdom som rammer en stor del av verdens befolkning.
Med kalsiumsulfid kan andre forbindelser som kalsiumnitrat og kalsiumkarbonat oppnås. Det må håndteres med forsiktighet og i kontakt med luftfuktigheten i atmosfæren det kan produsere HtoS som er veldig giftig.
Artikkelindeks
- 1 Struktur
- 2 Nomenklatur
- 3 Fysiske egenskaper
- 3.1 Fysisk tilstand
- 3.2 Molekylvekt
- 3.3 Smeltepunkt
- 3.4 Tetthet
- 3.5 Løselighet
- 4 Kjemiske egenskaper
- 4.1 Vandig løsning
- 4.2 Forbindelser tilstede når de er oppløst i vann
- 4.3 Reaksjon med syrer
- 4.4 Andre reaksjoner
- 5 Motta
- 5.1 Tilstedeværelse i naturen
- 6 bruksområder
- 6.1 I lysende materialer
- 6.2 I medisin
- 6.3 Ved oppnåelse av andre forbindelser
- 6.4 Andre bruksområder
- 7 Risiko
- 8 Referanser
Struktur
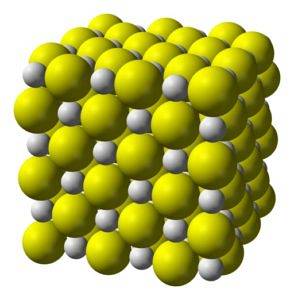
Kalsiumsulfid er en svært ionisk forbindelse dannet av et kalsiumion Cato+ og et sulfidion Sto-.
Krystalliserer til en kubisk struktur som steinsalt.
Nomenklatur
- Kalsiumsulfid
Fysiske egenskaper
Fysisk tilstand
Gulhvite krystallinske faste, kubiske krystaller som natriumklorid.
Molekylær vekt
72,144 g / mol
Smeltepunkt
2528 ºC
Tetthet
2,59 g / cm3
Løselighet
Løselig i vann. Uoppløselig i etanol.
Kjemiske egenskaper
Vandig løsning
Når CaS oppløses i vann, skilles det i kalsium Ca-ionene. to+ og svovel Sto-. Sistnevnte i vann tar en proton og blir hydrosulfidion SH- frigjøring av et hydroksylion OH-.
Sto- + HtoO ⇔ SH- + Åh-
Derfor er kalsiumsulfid CaS-oppløsninger alkaliske (har en grunnleggende pH) og har ikke S-ioner.to- men SH-.
Bare når en stor mengde alkali som natriumhydroksyd NaOH tilsettes løsningen, skifter likevekten mot dannelsen av sulfidioner Sto-.

SH- kan ta et nytt proton H+ fra vann og danner hydrogensulfid, som er en veldig giftig forbindelse.
SH- + HtoO ⇔ HtoS + OH-
Av denne grunn dannes små mengder H i vann.toJa, og når det utsettes for fuktighet i miljøet, gir CaS en ubehagelig lukt som er typisk for hydrogensulfid.
Forbindelser tilstede når de er oppløst i vann
Resultatet av reaksjonene i vann angitt ovenfor er at Ca (SH) dannesto, Ca (OH)to og Ca (SH) (OH).
CaS + HtoO → Ca (SH) (OH)
Ca (SH) (OH) + HtoO → Ca (OH)to + HtoS
Reaksjon med syrer
De samme reaksjonene som oppstår i vann får CaS til å reagere med syrer som danner HtoS.
CaS + 2 HCl → CaClto + HtoS
Andre reaksjoner
Hvis en løsning av kalsiumsulfid oppvarmes med svovel, oppnås polysulfidionene S.4to- og S3to-.
Hvis CaS oppvarmes i tørr luft eller rent oksygen, oksiderer forbindelsen til kalsiumsulfitt CaSO3 og deretter til kalsiumsulfat CaSO4:
2 CaS + 3 Oto → 2 CaSO3
2 CaSO3 + ELLERto → 2 CaSO4
Med oksidasjonsmidler som kaliumklorat KClO3, kaliumnitrat KNO3 eller blydioksid PbOto voldelige reaksjoner oppstår.
Å skaffe
Kalsiumsulfid kan fremstilles ved kalsinering (oppvarming til veldig høy temperatur) av elementene kalsium (Ca) og svovel (S) i en inert atmosfære, det vil si for eksempel ingen oksygen eller vanndamp..
Ca + S + varme → CaS
Det kan også oppnås ved oppvarming av kalsiumsulfat CaSO4 med kull:
Sak4 + 2 C → CaS + 2 COto
I sistnevnte tilfelle oppnås imidlertid ikke en ren CaS, da den reagerer i tillegg med CaSO4 danner CaO og SOto.
CaS genereres også ved forbrenning av kullavfall.
Tilstedeværelse i naturen
CaS er naturlig til stede i mineralet oldhamite. Dette er en komponent av noen meteoritter og er viktig for vitenskapelig forskning utført på solsystemet..
Oldhamite antas å ha dannet seg ved kondens i tåken som stammer fra solsystemet. Det er også til stede i vulkaner.

I tillegg produseres kalsiumsulfid naturlig ved reduksjon av CaSO4 (gips) muligens på grunn av virkningen av bakterier.
applikasjoner
I lysende materialer
En av de mest utbredte bruken av kalsiumsulfid har vært som en base for selvlysende forbindelser. Dette er stoffer som avgir synlig lys under visse omstendigheter..
I de selvlysende forbindelsene til CaS fungerer dette som en base, og aktivatorer tilsettes strukturen slik som klorider av visse elementer som cerium (Ce3+) og europium (Euto+).
Materialet som er resultatet av foreningen av CaS og aktivatoren brukes for eksempel i katodestrålerør som utgjør de gamle skjermene på datamaskiner eller datamaskiner eller gamle TV-apparater.

De brukes også i nåværende lysdioder eller LED-lamper. Lysdioder).

Disse materialene brukes også i lysende maling og lakk..
I medisin
Kalsiumsulfid har blitt vurdert i medisinske vitenskapelige studier som et legemiddel for å behandle høyt blodtrykk (høyt trykk i arteriene). Dette er en sykdom som påvirker det kardiovaskulære systemet til mange mennesker (hjerte og blodkar).
CaS regnes som en “donor” av HtoS. Dette spiller en viktig rolle i reguleringen av blodkarets tone eller styrke, slik at administrering av CaS kan være et mulig middel for å behandle hypertensjon..

Ved å oppnå andre forbindelser
Kalsiumsulfid gjør det mulig å fremstille andre forbindelser som kalsiumnitrat Ca (NO3)to:
CaS + 2 HNO3 → Ca (NO3)to + HtoS
Det har også blitt brukt for å oppnå kalsiumkarbonat CaCO3. For å gjøre dette utsettes en vandig løsning av CaS for karbonatisering med COto:
CaS + HtoO + COto → HtoS + CaCO3
Andre apper
Kalsiumsulfid brukes også som et smøremiddeladditiv og som et flotasjonsmiddel i mineralekstraksjon..
Risiko
Kalsiumsulfid kan forårsake irritasjon av hud, øye og luftveier. Det må håndteres med forsiktighet og med tilstrekkelig sikkerhetsutstyr.
Det er en veldig giftig forbindelse for vannlevende organismer, så det er farlig for disse miljøene.
Referanser
- Cotton, F. Albert og Wilkinson, Geoffrey. (1980). Avansert uorganisk kjemi. Fjerde utgave. John Wiley & Sons.
- Lide, D.R. (redaktør). (2005). CRC Håndbok for kjemi og fysikk. 85th CRC Trykk.
- Ropp, R.C. (2013). Gruppe 16 (O, S, Se, Te) alkaliske jordforbindelser. Kalsiumsulfid. I Encyclopedia of the Alkaline Earth Compounds. Gjenopprettet fra sciencedirect.com.
- Li, Y.F. et al. (2009). Kalsiumsulfid (CaS), en donor av hydrogensulfid (H (2) S): et nytt antihypertensivt middel? Med Hypoteser, 2009 sep; 73 (3): 445-7. Gjenopprettet fra ncbi.nlm.nih.gov.
- Hus J.E. and House, K.A. (2016). Svovel, selen og tellur. Forekomst av svovel. In Descriptive Inorganic Chemistry (tredje utgave). Gjenopprettet fra sciencedirect.com.
- OSS. National Library of Medicine. (2019). Kalsiumsulfid. Gjenopprettet fra pubchem.ncbi.nlm.nih.gov.
- De Beer, M. et al. (2014). Omdannelse av kalsiumsulfid til kalsiumkarbonat under utvinning av elementært svovel fra gipsavfall. Waste Manag, 2014 nov; 34 (11): 2373-81. Gjenopprettet fra ncbi.nlm.nih.gov.


Ingen har kommentert denne artikkelen ennå.