
Zinksulfid (ZnS) struktur, egenskaper og bruksområder
De sinksulfid er en uorganisk forbindelse med formel ZnS, dannet av Zn-kationerto+ og S anionerto-. Det finnes i naturen hovedsakelig som to mineraler: wurtzite og sphalerite (eller sink blende), sistnevnte er dens viktigste form.
Sphalerite er svart i naturen på grunn av urenheter den presenterer. I sin rene form har den hvite krystaller, mens wurtzitt har gråhvite krystaller..

Sinksulfid er uoppløselig i vann. Det kan forårsake miljøskader, siden det trenger inn i jorden og forurenser grunnvannet og dets strømmer.
Sinksulfid kan produseres, blant annet ved korrosjon og ved nøytralisering.
Ved korrosjon:
Zn + HtoS => ZnS + Hto
Ved nøytralisering:
HtoS + Zn (OH)to => ZnS + 2HtoELLER
Sinksulfid er et fosforescerende salt som gir det kapasitet for flere bruksområder. I tillegg er det en halvleder og en fotokatalysator.
Artikkelindeks
- 1 Struktur
- 1.1 Sinkblende
- 1.2 Wurzita
- 2 eiendommer
- 2.1 Farge
- 2.2 Smeltepunkt
- 2.3 Løselighet i vann
- 2.4 Løselighet
- 2,5 Tetthet
- 2.6 Hardhet
- 2.7 Stabilitet
- 2.8 Nedbrytning
- 3 Nomenklatur
- 3.1 Systematiske og tradisjonelle nomenklaturer
- 4 bruksområder
- 4.1 Som pigmenter eller belegg
- 4.2 På grunn av fosforcens
- 4.3 Halvleder, fotokatalysator og katalysator
- 5 Referanser
Struktur
Sinksulfid vedtar krystallinske strukturer styrt av elektrostatiske attraksjoner mellom Zn-kationento+ og anionen Sto-. Dette er to: sphaleritt eller sinkblende og wurzitt. I begge deler minimerer ionene frastøting mellom ioner med like ladning..
Sinkblendingen er den mest stabile i de terrestriske forholdene for trykk og temperatur; og wurzitt, som er mindre tett, skyldes krystallinsk omlegging på grunn av økt temperatur.
De to strukturene kan eksistere samtidig i det samme ZnS-faste stoffet, selv om wurzitten veldig sakte vil dominere..
Sink blende

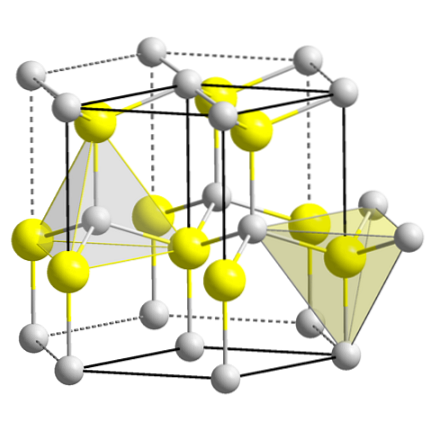
Det øvre bildet viser den kubiske enhetscellen sentrert på ansiktene til sink blende-strukturen. De gule kulene tilsvarer anionene Sto-, og de grå til Zn-kationeneto+, plassert i hjørnene og i midten av terningflatene.
Legg merke til de tetraedriske geometriene rundt ionene. Sinkblendingen kan også representeres av disse tetraedrene, hvis hull inne i krystallet har samme geometri (tetraedriske hull).
På samme måte oppnås ZnS-andelen innenfor enhetscellene; det vil si et forhold på 1: 1. Dermed for hvert Zn-kationto+ det er en anion Sto-. På bildet kan det virke som om det er mange grå kuler, men i virkeligheten deles de av andre celler siden de er i hjørnene og i midten av kubens ansikter..
Hvis du for eksempel tar de fire gule kulene som er inne i esken, skal "stykkene" av alle de grå kulene rundt den være lik (og de gjør) fire. I den kubiske enhetscellen er det således fire Znto+ og fire Sto-, oppfyller det støkiometriske forholdet ZnS.
Det er også viktig å understreke at det er tetraedriske hull foran og bak de gule kulene (rommet som skiller dem fra hverandre).
Wurzita
I motsetning til strukturen til sink blende, vedtar wurzitt et sekskantet krystallsystem (toppbilde). Dette er mindre kompakt, så det faste stoffet har lavere tetthet. Ionene i wurzitt har også tetraedrale omgivelser og et forhold 1: 1 som stemmer overens med ZnS-formelen..
Eiendommer
Farge
Det kan presenteres på tre måter:
-Wurtzite, med hvite og sekskantede krystaller.
-Sphalerite, med gråhvite krystaller og kubiske krystaller.
-Som et hvitt til gråhvit eller gulaktig pulver og kubiske gulkrystaller.
Smeltepunkt
1700 ºC.
Vannløselighet
Praktisk talt uoppløselig (0,00069 g / 100 ml ved 18 ° C).
Løselighet
Uoppløselig i baser, løselig i fortynnede mineralsyrer.
Tetthet
Sphalerite 4,04 g / cm3 og wurtzite 4,09 g / cm3.
Hardhet
Har en hardhet på 3 til 4 på Mohs-skalaen.
Stabilitet
Når den inneholder vann, oksiderer den sakte til sulfat. I et tørt miljø er det stabilt.
Nedbrytning
Ved oppvarming til høye temperaturer avgir den giftige damper av sink og svoveloksider.
Nomenklatur
Elektronkonfigurasjonen til Zn er [Ar] 3d104sto. Ved å miste de to elektronene i 4s orbital forblir den som Zn-kationto+ med fylte orbitaler. Derfor, siden elektronisk Znto+ det er mye mer stabilt enn Zn+, den har bare en valens på +2.
Derfor er den utelatt for stamnomenklaturen, og tilfører valensen i parentes og med romertall: sinksulfid (II).
Systematiske og tradisjonelle nomenklaturer
Men det er andre måter å ringe ZnS i tillegg til den som allerede er hevet. I systematikk er antall atomer for hvert element spesifisert med de greske tellerne; med det eneste unntaket av elementet til høyre når det bare er ett. Dermed blir ZnS navngitt som: apesinksulfid (og ikke monosinkmonosulfid).
Med hensyn til den tradisjonelle nomenklaturen tilsettes sink med en enkelt valens på +2 ved å legge til suffikset -ico. Følgelig resulterer dets tradisjonelle navn: sinksulfidico.
applikasjoner
Som pigmenter eller belegg
-Sachtolith er et hvitt pigment laget av sinksulfid. Brukes i caulks, mastics, tetningsmasse, undercoats, latex maling og skilting.
Dens bruk i kombinasjon med ultrafiolett lysabsorberende pigmenter, slik som mikrotitan eller gjennomsiktige jernoksidpigmenter, er nødvendig i værbestandige pigmenter.
-Når ZnS påføres på latex eller teksturmaling, har den en langvarig mikrobicid virkning.
-På grunn av sin store hardhet og motstand mot brudd, erosjon, regn eller støv, gjør den den egnet for utvendige infrarøde vinduer eller i flyrammer.
-ZnS brukes i belegg av rotorer som brukes i transport av forbindelser, for å redusere slitasje. Det brukes også til produksjon av trykkfarger, isolerende forbindelser, termoplastisk pigmentering, flammebestandig plast og elektroluminescerende lamper..
-Sinksulfid kan være gjennomsiktig og kan brukes som et vindu for synlig optikk og infrarød optikk. Brukes i nattsynsapparater, TV-skjermer, radarskjermer og fluorescerende belegg.
-ZnS med Cu-doping brukes til produksjon av elektroluminescenspaneler. Det brukes også i rakettfremdrift og gravimetri.
For fosforesens
-Dens fosforesens brukes til å fargelegge klokkene og dermed vise tiden i mørket; også i maling for leker, i nødskilt og trafikkadvarsler.
Fosforescens tillater bruk av sinksulfid i katodestrålerør og røntgenskjermer for å lyse i mørke flekker. Fargen på fosforcens avhenger av aktivatoren som brukes.
Halvleder, fotokatalysator og katalysator
-Sphalerite og wurtzite er halvledere med bredbåndsspalt. Sphalerite har en båndspalte på 3,54 eV, mens wurtzite har en båndspalte på 3,91 eV.
-ZnS brukes til fremstilling av en fotokatalysator sammensatt av CdS - ZnS / zirkonium - titanfosfat brukt til hydrogenproduksjon under synlig lys.
-Det fungerer som en katalysator for nedbrytningen av organiske forurensninger. Brukes til utarbeidelse av fargesynkronisering i LED-lamper.
-Dens nanokrystaller brukes til ultralydfølsom proteindeteksjon. For eksempel ved å sende ut lys fra kvanteprikker av ZnS. Den brukes til fremstilling av en kombinert fotokatalysator (CdS / ZnS) -TiO2 for elektrisk produksjon via fotoelektrokatalyse.
Referanser
- PubChem. (2018). Sinksulfid. Hentet fra: pubchem.ncbi.nlm.nih.gov
- QuimiNet. (2015, 16. januar). Hvitt pigment basert på sinksulfid. Gjenopprettet fra: quiminet.com
- Wikipedia. (2018). Sinksulfid. Hentet fra: en.wikipedia.org
- II-VI UK. (2015). Sinksulfid (ZnS). Hentet fra: ii-vi.es
- Rob Toreki. (2015, 30. mars). Zincblende (ZnS) -strukturen. Hentet fra: ilpi.com
- Kjemi LibreTexts. (22. januar 2017). Structure-Sink Blende (ZnS). Hentet fra: chem.libretexts.org
- Reade. (2018). Sinksulfid / Zinksulfid (ZnS). Hentet fra: reade.com

Ingen har kommentert denne artikkelen ennå.