
Periodisk tabell over elementer historie, struktur, elementer

De periodisk tabell over elementer er et verktøy som lar deg konsultere de kjemiske egenskapene til de 118 elementene som hittil er kjent. Det er viktig når du utfører støkiometriske beregninger, forutsier de fysiske egenskapene til et element, klassifiserer dem og finner periodiske egenskaper blant dem alle..
Atomer blir tyngre ettersom kjernene deres tilfører protoner og nøytroner, som også må ledsages av nye elektroner; Ellers ville elektrononeutralitet ikke være mulig. Dermed er noen atomer veldig lette, slik som hydrogen, og andre, supertunge, som oganeson.
Hvem skylder et slikt hjerte i kjemi? Til forskeren Dmitri Mendeleev, som i 1869 (for nesten 150 år siden) etter et tiår med teoretiske studier og eksperimenter publiserte den første periodiske tabellen i et forsøk på å organisere de 62 elementene som var kjent på den tiden.
For dette stolte Mendeleev på kjemiske egenskaper, samtidig som Lothar Meyer publiserte en annen periodisk tabell som var organisert i henhold til de fysiske egenskapene til elementene..
Opprinnelig inneholdt tabellen "tomme rom", hvis elementer ikke hadde vært kjent de årene. Imidlertid var Mendeleev i stand til å forutsi flere av egenskapene med betydelig nøyaktighet. Noen av disse elementene var: germanium (som han kalte eka-silisium) og gallium (eka-aluminium).
De første periodiske tabellene ordnet elementene i henhold til atommassene. Denne ordren avslørte en viss periodisitet (repetisjon og likhet) i de kjemiske egenskapene til elementene; overgangselementene stemte imidlertid ikke overens med denne ordren, og heller ikke edelgassene.
Av denne grunn var det nødvendig å bestille elementene med tanke på atomnummeret (antall protoner), i stedet for atommassen. Herfra, sammen med hardt arbeid og bidrag fra mange forfattere, ble Mendeleevs periodiske tabell raffinert og fullført..
Artikkelindeks
- 1 Historien til det periodiske systemet
- 1.1 Elementer
- 1.2 Symbologi
- 1.3 Utvikling av ordningen
- 1.4 Tellurisk skrue av Chancourtois (1862)
- 1.5 Octaves of Newlands (1865)
- 1.6 Mendeleevs bord (1869)
- 1.7 Moseleys periodiske tabell (nåværende periodisk tabell) - 1913
- 2 Hvordan er det organisert? (Struktur og organisering)
- 2.1 Perioder
- 2.2 Grupper
- 2.3 Antall protoner vs valenselektroner
- 3 Elementer i det periodiske systemet
- 3.1 Blokkering s
- 3,2 p blokk
- 3.3 Representative elementer
- 3.4 Overgangsmetaller
- 3.5 Interne overgangsmetaller
- 3.6 Metaller og ikke-metaller
- 3.7 Metallfamilier
- 3.8 Metalloider
- 3.9 Gasser
- 4 Bruk og applikasjoner
- 4.1 Forutsigelse av oksydformler
- 4.2 Valenser av elementene
- 4.3 Digitale periodiske tabeller
- 5 Betydningen av det periodiske systemet
- 6 Referanser
Historien til det periodiske systemet
Elementer
Bruk av elementer som grunnlag for å beskrive miljøet (nærmere bestemt naturen) har blitt brukt siden eldgamle tider. På den tiden ble de imidlertid referert til som materiens faser og tilstander, og ikke på den måten det er referert til fra middelalderen..
De gamle grekerne mente at planeten vi bor bestod av de fire grunnleggende elementene: ild, jord, vann og luft..
På den annen side var antall elementer i det gamle Kina fem, og i motsetning til grekerne ekskluderte disse luft og inkluderte metall og tre..

Den første vitenskapelige oppdagelsen ble gjort i 1669 av det tyske Henning Brand, som oppdaget fosfor; fra den datoen ble alle påfølgende poster registrert.

Det er verdt å avklare at noen elementer som gull og kobber allerede var kjent før fosfor; forskjellen er at de aldri ble registrert.
Symbologi
Alkymistene (forfedrene til dagens kjemikere) ga navn til elementene i forhold til konstellasjonene, deres oppdagere og stedene der de ble oppdaget.
I 1808 foreslo Dalton en serie tegninger (symboler) for å representere elementene. Senere ble dette notasjonssystemet erstattet av Jhon Berzelius (brukt til dags dato), siden Daltons modell ble mer komplisert etter hvert som nye elementer dukket opp..
Ordningsutvikling
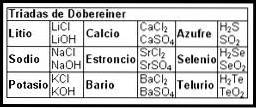
De første forsøkene på å lage et kart som organiserte informasjonen om de kjemiske elementene, skjedde på 1800-tallet med Döbereiner-triadene (1817).
Gjennom årene ble det funnet nye elementer som ga nye organisasjonsmodeller til den som brukes..
Chancourtois Telluric Skrue (1862)
Alexandré-Émile Béguyer de Chancourtois designet en papirhelix som viser en graf med spiraler (tellurskrue).
I dette systemet ordnes elementene i økende rekkefølge med hensyn til deres atomvekt. Lignende gjenstander er vertikalt justert.
Octaves of Newlands (1865)
Fortsett med Döbereiners arbeid arrangerte britiske John Alexander Reina Newlands de kjemiske elementene i økende rekkefølge med hensyn til atomvekter, og bemerket at hvert syv grunnstoff hadde likheter i deres egenskaper (hydrogen er ikke inkludert).
Mendeleevs bord (1869)
Mendeleev ordnet de kjemiske elementene i økende rekkefølge med hensyn til atomvekt, og plasserte i samme kolonne de som hadde lignende egenskaper. Han satte hull i sin periodiske tabellmodell for å forutse utseendet til nye elementer i fremtiden (i tillegg til å forutsi egenskapene den burde ha).
Edelgasser vises ikke i Mendeleevs bord, siden de ennå ikke hadde blitt oppdaget. Videre vurderte Mendeleiv ikke hydrogen.
Moseleys periodiske tabell (nåværende periodisk tabell) - 1913
Henry Gwyn Jeffreys Moseley foreslo å bestille de kjemiske elementene i det periodiske systemet i henhold til deres atomnummer; det vil si som en funksjon av antall protoner.
Moseley fortalte den "periodiske loven" i 1913: "Når grunnstoffene er ordnet etter deres atomnummer, viser deres fysiske og kjemiske egenskaper periodiske trender".
Dermed viser hver horisontale rad eller periode en type forhold, og hver kolonne eller gruppe viser en annen..
Hvordan er det organisert? (Struktur og organisering)
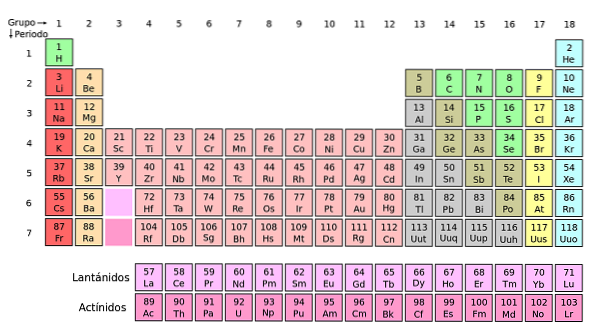
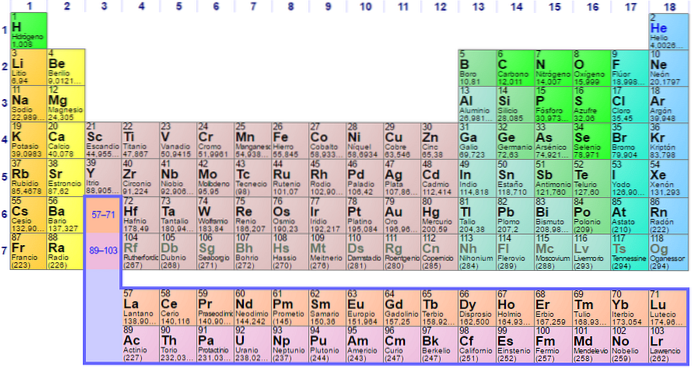
Det kan sees at pastellen i det periodiske bordet har flere farger. Hver farge forbinder elementer med lignende kjemiske egenskaper. Det er oransje, gule, blå, lilla kolonner; grønne firkanter, og en eplegrønn diagonal.
Merk at cellene i de midterste kolonnene er gråaktige i fargen, så alle disse elementene må ha noe til felles, det vil si at de er overgangsmetaller med halvfulle d-orbitaler..
På samme måte er elementene i de lilla firkanter, selv om de går fra gassformige stoffer, fra en rødaktig væske til fast svartlilla (jod) og sølvgrå (astatin), det er deres kjemiske egenskaper som gjør dem til kongener. Disse egenskapene styres av de elektroniske strukturene til atomene..
Organiseringen og strukturen til det periodiske systemet er ikke vilkårlig, men følger en serie med periodiske egenskaper og verdimønstre som er bestemt for elementene. For eksempel, hvis metalltegnet synker fra venstre til høyre for bordet, kan det ikke forventes et metallelement i øvre høyre hjørne.
Perioder
Elementene er ordnet i rader eller perioder avhengig av energinivået til deres orbitaler. Før perioden 4, da elementene lyktes i hverandre i økende rekkefølge av atommasse, ble det funnet at for hver åtte av dem gjentok de kjemiske egenskapene igjen (John Newlands 'oktavlov).
Overgangsmetallene ble støpt med andre ikke-metalliske elementer, som svovel og fosfor. Av denne grunn var oppføringen av kvantefysikk og elektronkonfigurasjoner avgjørende for forståelsen av moderne periodiske tabeller..
Orbitalene til et energiskall fylles opp med elektroner (og kjerner av protoner og nøytroner) når det beveger seg gjennom en periode. Dette energilaget går hånd i hånd med størrelsen eller atomradiusen; derfor er elementene i de øvre periodene mindre enn de som er under.
H og Han er på det første (periode) energinivået; den første raden med gråaktige firkanter, i fjerde periode; og raden med oransje firkanter, i den sjette perioden. Merk at selv om sistnevnte ser ut til å være i den antatte niende perioden, tilhører den faktisk den sjette, like etter den gule boksen med Ba.
Grupper
Gjennom en periode er det funnet at massen, antall protoner og elektroner øker. I samme kolonne eller gruppe, selv om massen og protonene varierer, vil antallet valens skallelektroner er lik.
For eksempel, i den første kolonnen eller gruppen, har H et enkelt elektron i 1-orbitalen1, som Li (2s1), natrium (3s1), kalium (4s1) og så videre til francium (7s1). At nummer 1 betegner at disse elementene neppe har et valenselektron, og derfor tilhører gruppe 1 (IA). Hvert element er i forskjellige perioder.
Når vi ikke teller hydrogen med grønne bokser, er elementene under den oransje og kalles alkalimetaller. En boks til høyre i en periode, er gruppen eller kolonne 2; det vil si at elementene har to valenselektroner.
Men når man beveger seg et skritt videre mot høyre, uten kjennskap til d-orbitalene, kommer man til boregruppen (B) eller gruppe 13 (IIIA); i stedet for gruppe 3 (IIIB) eller skandium (Sc). Når man tar hensyn til fyllingen av d-orbitalene, begynner man å gå gjennom periodene av de gråaktig firkantene: overgangsmetallene.
Antall protoner vs valenselektroner
Når man studerer det periodiske systemet, kan det oppstå forvirring mellom atomnummeret Z eller antall totale protoner i kjernen, og antall valenselektroner. For eksempel har karbon en Z = 6, det vil si at den har seks protoner og derfor seks elektroner (ellers kan det ikke være et nøytralt ladet atom).
Men av de seks elektronene, fire er fra valencia. Av den grunn er elektronkonfigurasjonen [He] 2sto2 sto. [Han] betegner de to 1-elektroneneto av det lukkede laget, og teoretisk ikke delta i dannelsen av kjemiske bindinger.
Også fordi karbon har fire valenselektroner, er det "beleilig" lokalisert i gruppe 14 (IVA) i det periodiske systemet..
Elementene under karbon (Si, Ge, Sn, Pb og Fl) har høyere atomnummer (og atommasser); men de har alle de fire valenselektronene til felles. Dette er nøkkelen til å forstå hvorfor et element tilhører en gruppe og ikke en annen..
Elementer i det periodiske systemet
Blokker s
Som nettopp forklart, er gruppe 1 og 2 preget av å ha en eller to elektroner i sin orbital. Disse orbitalene har sfærisk geometri, og når man kommer ned gjennom noen av disse gruppene, får elementene lag som øker størrelsen på deres atomer..
Fordi de presenterer sterke tendenser i sine kjemiske egenskaper og reaksjonsmåter, er disse elementene organisert som s-blokken. Derfor tilhører alkalimetallene og jordalkalimetallene denne blokken. Elektronkonfigurasjonen til elementene i denne blokken er ns (1s, 2s, etc.).
Selv om elementet helium er i øvre høyre hjørne av tabellen, er elektronkonfigurasjonen 1sto og tilhører derfor denne blokken.
Blokker s
I motsetning til s-blokken har elementene i denne blokken fullstendig fylt s-orbitaler, mens deres p-orbitaler fortsetter å bli fylt med elektroner. De elektroniske konfigurasjonene av elementene som tilhører denne blokken er av typen nstonp1-6 (p-orbitaler kan ha en eller opptil seks elektroner å fylle).
Så hvor på det periodiske systemet ligger denne blokken? Til høyre: de grønne, lilla og blå rutene; dvs. ikke-metalliske elementer og tungmetaller, så som vismut (Bi) og bly (Pb).
Starter med bor, med elektronkonfigurasjon nstonp1, karbonet til høyre legger til et annet elektron: 2sto2 sto. Deretter er elektronkonfigurasjonene til de andre elementene i periode 2 i blokk p: 2sto2 s3 (nitrogen), 2sto2 s4 (oksygen), 2sto2 s5 (fluor) og 2sto2 s6 (neon).
Hvis du går ned til de lavere periodene, vil du ha energinivået 3: 3sto3p1-6, og så videre til slutten av blokken s.
Merk at det viktigste med denne blokken er at elementene i perioden 4 har fullstendig fylt d orbitaler (blå bokser til høyre). Kort sagt: blokk s er til venstre for det periodiske systemet, og blokk p til høyre.
Representative elementer
Hva er de representative elementene? Det er de som på den ene siden lett mister elektroner, eller på den annen side får dem til å fullføre oktens av valens. Med andre ord: de er elementene i blokkene s og p.
Gruppene deres ble skilt fra de andre med bokstaven A på slutten. Dermed var det åtte grupper: fra IA til VIIIA. Men for tiden er nummereringssystemet som brukes i moderne periodiske tabeller arabisk, fra 1 til 18, inkludert overgangsmetallene..
Av den grunn kan borgruppen være IIIA, eller 13 (3 + 10); karbongruppen, mva eller 14; og for edelgasser, den siste til høyre for bordet, VIIIA eller 18.
Overgangsmetaller
Overgangsmetallene er alle elementene i de gråaktige rutene. Gjennom hele periodene fylles deres d-orbitaler, som er fem og kan derfor ha ti elektroner. Siden de må ha ti elektroner for å fylle disse orbitalene, må det være ti grupper eller kolonner.
Hver av disse gruppene i det gamle nummereringssystemet ble utpekt med romertall og bokstav B på slutten. Den første gruppen, den for skandium, var IIIB (3), den for jern, kobolt og nikkel VIIIB for å ha veldig like reaktiviteter (8, 9 og 10), og den for sink IIB (12).
Som det fremgår er det mye lettere å gjenkjenne grupper etter arabiske tall enn ved å bruke romerske tall..
Interne overgangsmetaller
Per periode 6 i det periodiske systemet blir f-orbitalene energisk tilgjengelige. Disse må fylles ut først enn d-orbitalene; og derfor er elementene vanligvis plassert fra hverandre for ikke å forlenge bordet for mye.
De to siste periodene, oransje og grå, er de indre overgangsmetallene, også kalt lantanider (sjeldne jordarter) og aktinider. Det er syv f orbitaler, som trenger fjorten elektroner å fylle, og derfor må det være fjorten grupper.
Hvis disse gruppene blir lagt til i det periodiske systemet, vil det være totalt 32 (18 + 14) og det vil være en “lang” versjon:
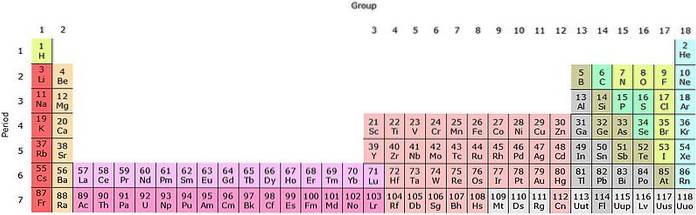
Den lysrosa raden tilsvarer lanthanoidene, mens den mørkrosa raden tilsvarer actinoidene. Lanthanum, La med Z = 57, actinium, Ac med Z = 89, og hele f-blokken tilhører samme gruppe som skandium. Hvorfor? Fordi skandium har en andre bane1, som er tilstede i resten av lanthanoider og actinoider.
La og Ac har 5d valensinnstillinger16sto og 6d17sto. Når du beveger deg mot høyre gjennom begge radene, begynner orbitalene 4f og 5f å fylles. Når du er fylt, kommer du til elementene lutetium, Lu og laurencio, Lr.
Metaller og ikke-metaller
Etterlater kaken i det periodiske bordet, er det mer praktisk å ty til den i det øverste bildet, selv i sin langstrakte form. For øyeblikket har de aller fleste elementene vært metaller.
Ved romtemperatur er alle metaller faste stoffer (unntatt kvikksølv, som er flytende) med en sølvgrå farge (unntatt kobber og gull). Også, de pleier å være harde og skinnende; selv om de i blokk s er myke og sprø. Disse elementene er preget av deres lette å miste elektroner og danne kationer M+.
Når det gjelder lanthanoider, mister de alle tre 5d-elektronene16sto å bli treverdige kationer M3+ (som henne3+). Cerium er på sin side i stand til å miste fire elektroner (Ce4+).
På den annen side utgjør ikke-metalliske elementer den minste delen av det periodiske systemet. De er gasser eller faste stoffer med kovalent koblede atomer (som svovel og fosfor). Alle er plassert i blokk p; mer presist, i den øvre delen av den, siden nedstigning til nedre perioder øker metallkarakteren (Bi, Pb, Po).
Også, ikke-metaller i stedet for å miste elektroner, får du dem. Dermed danner de anioner X- med forskjellige negative ladninger: -1 for halogener (gruppe 17) og -2 for kalkogener (gruppe 16, oksygen).
Metalliske familier
Innen metall er det en intern klassifisering for å skille dem fra hverandre:
-Gruppe 1 metaller er alkaliske
-Gruppe 2, jordalkalimetaller (Mr. Becambara)
-Gruppe 3 (IIIB) skandiumfamilie. Denne familien består av skandium, leder av gruppen, av yttrium Y, lantan, aktinium og alle lantanoider og aktinoider.
-Gruppe 4 (IVB), titanfamilie: Ti, Zr (zirkonium), Hf (hafnium) og Rf (rutherfordium). Hvor mange valenselektroner har de? Svaret er i gruppen din.
-Gruppe 5 (VB), vanadiumfamilie. Gruppe 6 (VIB), kromfamilie. Og så videre opp til sinkfamilien, gruppe 12 (IIB).
Metalloider
Den metalliske karakteren øker fra høyre til venstre, og fra topp til bunn. Men hva er grensen mellom disse to typene kjemiske elementer? Denne grensen består av grunnstoffer kjent som metalloider, som har karakteristika for både metaller og ikke-metaller..
Metalloider kan sees på det periodiske systemet i "stigen" som begynner med bor og slutter med det radioaktive elementet astatin. Disse elementene er:
-B: bor
-Silisium: Ja
-Ge: germanium
-Som: arsen
-Sb: antimon
-Te: tellurium
-På: astatine
Hvert av disse syv elementene har mellomegenskaper, som varierer i henhold til kjemisk miljø eller temperatur. En av disse egenskapene er halvledning, det vil si metalloider er halvledere.
Gasser
Under terrestriske forhold er gasselementene de ikke-lette metaller, som nitrogen, oksygen og fluor. Også klor, hydrogen og edelgasser faller inn i denne klassifiseringen. Av alle er de mest emblematiske edelgassene på grunn av deres lave tendens til å reagere og oppføre seg som frie atomer..
Sistnevnte finnes i gruppe 18 i det periodiske systemet og er:
-Helium, han
-Neon, Ne
-Argon, Ar
-krypton, Kr
-Xenon, Xe
-Radon, Rn
-Og den siste av alt, den syntetiske edelgassen oganeson, Og.
Alle edelgasser har valenskonfigurasjonen ns til fellestonp6; det vil si at de har hele valensoktet.
Aggregasjoner av elementer ved andre temperaturer
Elementene er i fast, flytende eller gassformet tilstand avhengig av temperaturen og styrken av deres interaksjoner. Hvis jordens temperatur ble avkjølt til absolutt null (0K), ville alle elementene fryse; bortsett fra helium, som ville kondensere.
Ved denne ekstreme temperaturen ville resten av gassene være i form av is.
På den andre ekstremen, hvis temperaturen var omtrent 6000K, ville "alle" elementene være i gassform. Under disse forholdene kunne du bokstavelig talt se skyer av gull, sølv, bly og andre metaller.
Bruksområder og applikasjoner
Det periodiske systemet i seg selv har alltid vært og vil være et verktøy for å konsultere symbolene, atommassene, strukturer og andre egenskaper til elementene. Det er ekstremt nyttig når du utfører støkiometriske beregninger, som er dagens orden i mange oppgaver innen og utenfor laboratoriet.
Ikke bare det, men også det periodiske systemet lar deg sammenligne elementene i samme gruppe eller periode. Dermed kan man forutsi hvordan visse forbindelser av elementene vil være.
Forutsigelse av oksydformler
For eksempel, for alkalimetalloksider, fordi de har en enkelt valenselektron, og derfor en valens på +1, forventes formelen til deres oksider å være av M-typentoO. Dette kontrolleres med hydrogenoksid, vann, HtoO. Også med natriumoksider, NatoO, og kalium, KtoELLER.
For de andre gruppene må deres oksyder ha den generelle formelen MtoELLERn, hvor n er lik gruppetallet (hvis elementet er fra blokk p, beregnes n-10). Dermed danner karbon, som tilhører gruppe 14, COto (CtoELLER4/to); svovel, fra gruppe 16, SO3 (StoELLER6/to); og nitrogen, gruppe 15, NtoELLER5.
Dette gjelder imidlertid ikke overgangsmetaller. Dette er fordi jern, selv om det tilhører gruppe 8, ikke kan miste 8 elektroner men 2 eller 3. Derfor, i stedet for å huske formlene, er det viktigere å ta hensyn til valensene til hvert element..
Valenser av elementene
De periodiske tabellene (noen) viser mulige valenser for hvert element. Å vite disse, kan nomenklaturen til en forbindelse og dens kjemiske formel estimeres på forhånd. Valens, som nevnt tidligere, er relatert til gruppenummeret; selv om det ikke gjelder for alle grupper.
Valensene avhenger mer av den elektroniske strukturen til atomene, og hvilke elektroner de faktisk kan miste eller få..
Ved å vite antall valenselektroner, kan du også starte med Lewis-strukturen til en forbindelse fra denne informasjonen. Det periodiske systemet lar derfor studenter og fagpersoner tegne strukturer og vike for en undersøkelse av mulige geometrier og molekylære strukturer..
Digitale periodiske tabeller
I dag har teknologien tillatt at periodiske tabeller er mer allsidige og gir mer informasjon tilgjengelig for alle. Flere av dem gir slående illustrasjoner av hvert element, samt en kort oppsummering av dets viktigste bruksområder.
Måten du samhandler med dem på, får du raskere forståelse og studier. Det periodiske systemet skal være et verktøy som er behagelig for øyet, lett å utforske, og den mest effektive metoden å kjenne dets kjemiske elementer er å gå gjennom det fra perioder til grupper..
Betydningen av det periodiske systemet
I dag er det periodiske systemet det viktigste organiseringsverktøyet i kjemi på grunn av de detaljerte forholdene mellom elementene. Bruken er viktig både for studenter og lærere, så vel som for forskere og mange fagpersoner dedikert til grenen av kjemi og ingeniørfag..
Bare ved å se på det periodiske systemet får du en enorm mengde og informasjon raskt og effektivt, for eksempel:
- Litium (Li), beryllium (Be) og bor (B) leder strøm.
- Litium er et alkalimetall, beryllium er et jordalkalimetall, og bor er et ikke-metall.
- Litium er den beste lederen av de tre navngitte, etterfulgt av beryllium og til slutt bor (halvleder).
Ved å lokalisere disse elementene i det periodiske systemet kan deres tendens til elektrisk ledningsevne således umiddelbart konkluderes..
Referanser
- Scerri, E. (2007). Det periodiske systemet: historien og dens betydning. Oxford New York: Oxford University Press.
- Scerri, E. (2011). Det periodiske systemet: en veldig kort introduksjon. Oxford New York: Oxford University Press.
- Moore, J. (2003). Kjemi for dummies. New York, NY: Wiley Pub.
- Venable, F.P ... (1896). Utviklingen av den periodiske loven. Easton, Pennsylvania: Chemical Publishing Company.
- Ball, P. (2002). Ingrediensene: en guidet tur på elementene. Oxford New York: Oxford University Press.
- Whitten, Davis, Peck & Stanley. Kjemi. (8. utg.). CENGAGE Læring.
- Royal Society of Chemistry. (2018). Periodiske tabell. Gjenopprettet fra: rsc.org
- Richard C. Banks. (Januar 2001). Det periodiske systemet. Gjenopprettet fra: chemistry.boisestate.edu
- Fysikk 2000. (s.f.). Opprinnelsen til det periodiske systemet. Gjenopprettet fra: physics.bk.psu.edu
- King K. & Nazarewicz W. (7. juni 2018). Er det slutt på det periodiske systemet? Gjenopprettet fra: msutoday.msu.edu
- Dr. Doug Stewart. (2018). Det periodiske systemet. Gjenopprettet fra: chemicool.com
- Mendez A. (16. april 2010). Mendeleevs periodiske tabell. Gjenopprettet fra: quimica.laguia2000.com



Ingen har kommentert denne artikkelen ennå.