
Overføring hva er det, diagram over molekylær energi og trening
De overføring Optisk er kvotienten mellom den fremvoksende lysintensiteten og den innfallende lysintensiteten på en prøve av gjennomsiktig løsning som har blitt belyst med monokromatisk lys..
Den fysiske prosessen med passering av lys gjennom en prøve kalles lystransmisjon og overføring det er et mål på lystransmisjon. Transmisjon er en viktig verdi for å bestemme konsentrasjonen av en prøve som vanligvis er oppløst i et løsningsmiddel som vann eller alkohol, blant andre..
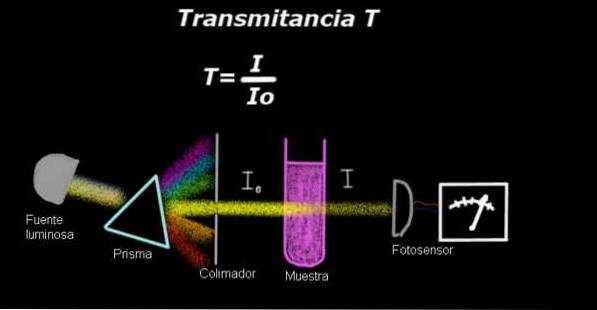
Et elektrofotometer måler en strøm som er proporsjonal med lysintensiteten som faller på overflaten. For å beregne overføring måles vanligvis intensitetssignalet som tilsvarer løsningsmidlet først, og dette resultatet blir registrert som Io.
Deretter plasseres den oppløste prøven i løsningsmidlet med de samme lysforholdene, og signalet målt av elektrofotometeret betegnes som Jeg, deretter beregnes overføringen i henhold til følgende formel:
T = jeg / jegeller
Det skal bemerkes at overføring er en dimensjonsløs størrelse, siden den er et mål på lysstyrken til en prøve i forhold til intensiteten av løsningsmiddeloverføringen..
Artikkelindeks
- 1 Hva er overføring?
- 1.1 Absorpsjon av lys i et medium
- 1.2 Molekylær teori om lysabsorpsjon
- 2 Molekylært energidiagram
- 2.1 Faktorer som overføring avhenger av
- 3 Øvelsen løst
- 3.1 Øvelse 1
- 4 Referanser
Hva er overføring?
Lysabsorpsjon i et medium
Når lys passerer gjennom en prøve, absorberes noe av lysenergien av molekylene. Transmittans er det makroskopiske målet på et fenomen som oppstår på molekylært eller atomnivå.
Lys er en elektromagnetisk bølge, energien den bærer er i det elektriske og magnetiske feltet til bølgen. Disse oscillerende feltene samhandler med molekylene til et stoff.
Energien båret av avhenger av frekvensen. Monokromatisk lys har en enkelt frekvens, mens hvitt lys har et område eller frekvensspekter..
Alle frekvenser av en elektromagnetisk bølge beveger seg i vakuum med samme hastighet på 300 000 km / s. Hvis vi betegner med c med lysets hastighet i vakuum, frekvensforholdet F og bølgelengde λ Det er:
c = λ⋅f
Hva c er en konstant ved hver frekvens tilsvarer dens respektive bølgelengde.
For å måle overføringen av et stoff, brukes områdene av det synlige elektromagnetiske spekteret (380 nm til 780 nm), det ultrafiolette området (180 til 380 nm) og det infrarøde området (780 nm til 5600 nm).
Formeringshastigheten for lys i et materialmedium avhenger av frekvensen og er mindre enn c. Dette forklarer spredningen i et prisme som frekvensene som utgjør hvitt lys kan skilles fra..
Molekylær teori om lysabsorpsjon
Atomer og molekyler har kvantiserte energinivåer. Ved romtemperatur har molekylene de laveste energinivåene.
Fotonen er kvantepartikkelen assosiert med den elektromagnetiske bølgen. Fotonens energi blir også kvantisert, det vil si et foton med frekvens F har energi gitt av:
E = h⋅f
hvor h er Plancks konstant hvis verdi er 6,62 × 10 ^ -34 J⋅s.
Monokromatisk lys er en stråle av fotoner med en gitt frekvens og energi.
Molekyler absorberer fotoner når energien samsvarer med forskjellen som er nødvendig for å bringe molekylet til et høyere energinivå.
Energioverganger ved absorpsjon av fotoner i molekyler kan være av flere typer:
1- Elektroniske overganger når elektronene til molekylære orbitaler går til orbitaler med høyere energi. Disse overgangene forekommer vanligvis i det synlige og ultrafiolette området og er de viktigste.
2- Vibrasjonsoverganger, de molekylære bindingsenergiene blir også kvantifisert, og når et foton fra det infrarøde området absorberes, går molekylet til en høyere vibrasjonsenergitilstand.
3- Rotasjonsoverganger, når absorpsjonen av et foton fører molekylet til en rotasjonstilstand med høyere energi.
Molekylær energidiagram
Disse overgangene forstås best med et molekylært energidiagram vist i figur 2:
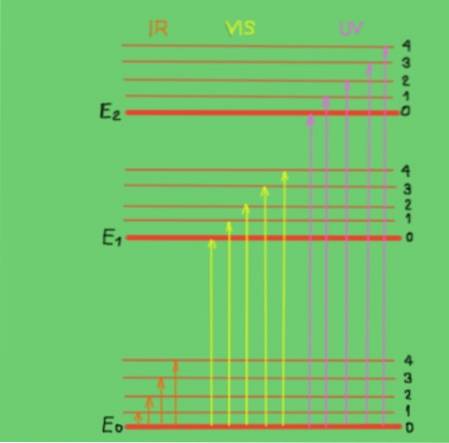
I diagrammet representerer de horisontale linjene forskjellige molekylære energinivåer. E0-linjen er det grunnleggende eller lavere energinivået. Nivåene E1 og E2 er spente nivåer med høyere energi. Nivåene E0, E1, E2 tilsvarer de elektroniske tilstandene til molekylet.
Undernivåene 1, 2, 3, 4 innenfor hvert elektroniske nivå tilsvarer de forskjellige vibrasjonstilstandene som tilsvarer hvert elektroniske nivå. Hvert av disse nivåene har finere underinndelinger som ikke er vist å svare til rotasjonstilstandene knyttet til hvert vibrasjonsnivå..
Diagrammet viser vertikale piler som representerer energien til fotoner i det infrarøde, synlige og ultrafiolette området. Som man kan se, har ikke infrarøde fotoner nok energi til å fremme elektroniske overganger, mens synlig og ultrafiolett stråling gjør det..
Når de innfallende fotonene til en monokromatisk stråle sammenfaller i energi (eller frekvens) med energidifferansen mellom molekylære energitilstander, oppstår absorpsjonen av fotoner..
Faktorer som overføring avhenger av
I følge det som ble sagt i forrige avsnitt, vil overføringen avhenge av flere faktorer, blant hvilke vi kan nevne:
1- Frekvensen som prøven lyser med.
2- Type molekyler som skal analyseres.
3- Konsentrasjonen av løsningen.
4- Lengden på stien som lysstrålen har reist.
De eksperimentelle dataene indikerer at overføringen T avtar eksponentielt med konsentrasjon C og med lengden L av den optiske banen:
T = 10-a⋅C⋅L
I ovenstående uttrykk til er en konstant som avhenger av frekvensen og typen stoff.
Treningen løst
Øvelse 1
En standardprøve av et bestemt stoff har en konsentrasjon på 150 mikromol per liter (μM). Når transmittansen måles med lys på 525 nm, oppnås en transmittans på 0,4..
En annen prøve av samme stoff, men med ukjent konsentrasjon, har en transmittans på 0,5, målt ved samme frekvens og med samme optiske tykkelse..
Beregn konsentrasjonen av den andre prøven.
Svar
Transmisjonen T forfaller eksponentielt med konsentrasjonen C:
T = 10-b⋅L
Hvis logaritmen til den forrige likheten tas, forblir den:
logg T = -b⋅C
Å dele medlem etter medlem den forrige likheten som ble brukt på hver prøve og løse for den ukjente konsentrasjonen gjenstår:
C2 = C1⋅ (logg T2 / logg T1)
C2 = 150μM⋅ (log 0,5 / log 0,4) = 150μM⋅ (-0,3010 / -0,3979) = 113,5 μM
Referanser
- Atkins, P. 1999. Fysisk kjemi. Omega-utgaver. 460-462.
- Guiden. Transmisjon og absorbans. Gjenopprettet fra: quimica.laguia2000.com
- Miljøtoksikologi. Overføring, absorbans og Lamberts lov. Gjenopprettet fra: repositorio.innovacionumh.es
- Fysisk eventyr. Absorbans og overføring. Gjenopprettet fra: rpfisica.blogspot.com
- Spektrofotometri. Gjenopprettet fra: chem.libretexts.org
- Miljøtoksikologi. Overføring, absorbans og Lamberts lov. Gjenopprettet fra: repositorio.innovacionumh.es
- Wikipedia. Overføring. Gjenopprettet fra: wikipedia.com
- Wikipedia. Spektrofotometri. Gjenopprettet fra: wikipedia.com



Ingen har kommentert denne artikkelen ennå.