
Fosforoksid (v) struktur, egenskaper, oppnåelse, bruk, risiko

De fosforoksid (v) Det er et uorganisk fast stoff dannet av fosfor (P) og oksygen (O). Den empiriske formelen er PtoELLER5, mens den korrekte molekylformelen er P4ELLER10. Det er et veldig hygroskopisk hvitt fast stoff, det vil si at det kan absorbere vann fra luften veldig enkelt, og reagerer umiddelbart med det. Reaksjonen kan være farlig da den forårsaker en rask økning i temperaturen.
Dens høye tendens til å absorbere vann har ført til at den brukes som tørkemiddel i kjemiske laboratorier, så vel som en dehydrator av noen forbindelser, det vil si å eliminere vann fra molekylene..

Fosforoksyd (v) brukes også til å akselerere bindingsreaksjonene til forskjellige hydrokarbonmolekyler, en reaksjon som kalles kondens. I tillegg tillater det å konvertere visse organiske syrer til estere.
Den har for eksempel blitt brukt til å raffinere bensin, for å fremstille fosforsyre H3PO4, for å oppnå forbindelser som tjener til å forsinke brann, for å lage glass for vakuumapplikasjoner, blant mange andre bruksområder.
Fosforoksid (v) bør oppbevares i tett lukkede beholdere for å forhindre at det kommer i kontakt med fuktighet i luften. Det er etsende og kan skade øyne, hud og slimhinner..
Artikkelindeks
- 1 Struktur
- 2 Nomenklatur
- 3 eiendommer
- 3.1 Fysisk tilstand
- 3.2 Molekylvekt
- 3.3 Smeltepunkt
- 3.4 Sublimeringstemperatur
- 3,5 Tetthet
- 3.6 Løselighet
- 3.7 Kjemiske egenskaper
- 3.8 Andre egenskaper
- 4 Motta
- 4.1 Tilstedeværelse i naturen
- 5 bruksområder
- 5.1 Som et dehydratiserings- og tørkemiddel
- 5.2 I organiske kjemiske reaksjoner
- 5.3 I drivstoffraffinering
- 5.4 I forskjellige applikasjoner
- 6 Risiko
- 7 Referanser
Struktur
Fosforoksyd (v) består av fosfor (P) og oksygen (O), hvor fosfor har en valens på +5 og oksygen -2. Fosforoksydmolekylet (v) har fire fosfor- og ti oksygenatomer, og det er derfor den riktige molekylformelen er P4ELLER10.
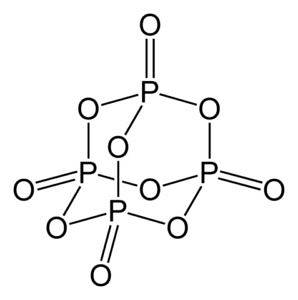
Den eksisterer i tre krystallinske former, som amorft pulver og i glasslegemet (som glass). I den sekskantede krystallinske formen er hvert av de fosforatomer funnet i toppunktene til en tetraeder..
Nomenklatur
- Fosforoksid (v)
- Fosforpentoksid
- Difosfor pentoksid
- Fosforpentoksid
- Fosforsyreanhydrid
- Tetrafosfor decaoxide
Eiendommer
Fysisk tilstand
Krystallinsk hvitt fast stoff. Den vanligste formen er sekskantede krystaller.
Molekylær vekt
283,89 g / mol
Smeltepunkt
562 ºC
Sublimeringstemperatur
360 ºC ved 1 atmosfæretrykk. Det betyr at det ved denne temperaturen går fra fast til gass uten å gå gjennom flytende tilstand.
Tetthet
2,30 g / cm3
Løselighet
Svært løselig i vann. Løselig i svovelsyre. Uoppløselig i aceton og ammoniakk.
Kjemiske egenskaper
Fosforoksyd (v) absorberer og reagerer ekstremt raskt med vann i luften og danner fosforsyre H3PO4. Denne reaksjonen er eksoterm, noe som betyr at det produseres varme under reaksjonen..
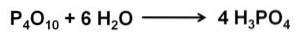
Reaksjonen til P4ELLER10 med vann fører til dannelsen av en blanding av fosforsyrer, hvis sammensetning avhenger av vannmengden og forholdene.
Reaksjonen med alkoholer fører til dannelse av estere av fosforsyre eller av polymere syrer avhengig av eksperimentelle forhold..
P4ELLER10 + 6 ROH → 2 (RO)toPO.OH + 2 RO.PO (OH)to
Med basiske oksider danner det faste fosfater.
Det er etsende. Kan reagere farlig med maursyre og uorganiske baser som natriumhydroksid (NaOH), kalsiumoksid (CaO) eller natriumkarbonat NatoCO3.
Hvis du heller en løsning av saltsyre HClO4 og kloroform CHCl3 i fosforoksyd (v) P4ELLER10 en voldsom eksplosjon oppstår.
Andre egenskaper
Det er ikke brannfarlig. Det fremmer ikke forbrenning. Imidlertid er reaksjonen med vann så voldsom og eksoterm at det kan være fare for brann..
Å skaffe
Det kan fremstilles ved direkte oksidasjon av fosfor i en strøm av tørr luft. Fosfor når det kommer i kontakt med overflødig oksygen oksyderer og danner fosforoksid (v).
P4 + 5 Oto → P4ELLER10
Tilstedeværelse i naturen
Fosfor (v) oksid finnes i mineraler som ilmenitt, rutil og zirkon.
Ilmenitt er et mineral som inneholder jern og titan og noen ganger har fosfor (v) oksid i konsentrasjoner som varierer mellom 0,04 og 0,33 vekt%. Rutil er et titanoksydmineral og kan inneholde ca. 0,02 vekt% PtoELLER5.
Zirkonsand (et mineral av elementet zirkonium) har fosforoksid (v) i 0,05-0,39 vekt%.
applikasjoner
Som et dehydratiserings- og tørkemiddel
På grunn av sin store grådighet etter vann er det et av de mest kjente dehydratiseringsmidlene og veldig effektivt ved temperaturer under 100 ° C..
Det kan trekke ut vann fra stoffer som selv betraktes som dehydratiserende midler. For eksempel kan du fjerne vann fra svovelsyre HtoSW4 gjør det om til SÅ3 og salpetersyre HNO3 gjør den om til NtoELLER5.

I utgangspunktet kan den tørke alle væskene og gassene som den ikke reagerer med, så det gjør det mulig å fjerne spor av fuktighet fra vakuumsystemer.
I organisk kjemi reaksjoner
Fosforoksyd (v) tjener til å lukke ringer av organiske forbindelser og andre kondensasjonsreaksjoner.
Det gjør det mulig å forestre organiske syrer med muligheten for å skille mellom primære alifatiske karboksylsyrer (karbonkjede uten ringer med -COOH-gruppen i den ene enden) og aromatiske syrer (-COOH-gruppe festet til benzenringen), siden sistnevnte ikke reagerer.
Det tjener også til å fjerne et molekyl av HtoO av amidene R (C = O) NHto og konverterer dem til R-CN nitriler. I tillegg katalyserer eller akselererer det oksygenering, dehydrogenering og polymerisasjonsreaksjoner av bitumen.

I drivstoffraffinering
Siden 30-tallet av 1900-tallet indikerte visse studier at fosfor (v) oksid utøvde en raffineringsvirkning på bensin, og økte oktantallet.
Raffinering av P4ELLER10 det skyldes hovedsakelig kondensasjonsreaksjoner (forening av forskjellige molekyler) og ikke polymerisering (forening av like molekyler).
Siden4ELLER10 akselererer direkte alkylering av aromatiske hydrokarboner med olefiner, omdannelse av olefiner til naftener og deres delvise polymerisering. Alkyleringsreaksjonen øker oktantallet av bensin.
På denne måten oppnås en raffinert bensin av høy kvalitet.

I forskjellige applikasjoner
Fosforoksyd (v) brukes til å:
- Forbered fosforsyre H3PO4
- Få akrylatestere og overflateaktive stoffer
- Forbered fosfatestere som brukes som flammehemmere, løsningsmidler og fortynningsmidler
- Konvertering av fosfortriklorid til fosforoksyklorid
- Laboratoriereagens
- Produserer spesialglass for vakuumrør
- Øk smeltepunktet for asfalt
- Serveres som et standardmolekyl ved bestemmelse av fosfor eller fosfater i fosfatbergart, gjødsel og Portland sement, i form av PtoELLER5
- Forbedre båndene mellom visse polymerer og elfenbensjiktet som tennene har

Risiko
Fosfor (v) oksid bør oppbevares i forseglede beholdere og på kjølig, tørt, godt ventilert sted.
Dette tjener til å forhindre at det kommer i kontakt med vann, da det kan reagere voldsomt med det, og generere mye varme, til det punktet å brenne nærliggende materialer som er brennbare..
Fosfor (v) oksydstøv irriterer øynene og luftveiene og er etsende for huden. Kan forårsake øyeskader. Svelging medfører dødelige brannskader.
Referanser
- OSS. National Library of Medicine. (2019). Fosforsyreanhydrid. Gjenopprettet fra pubchem.ncbi.nlm.nih.gov.
- Nayler, P. (2001). Bitumen: Modifisert. Kjemisk modifisering. I Encyclopedia of Materials: Science and Technology. Gjenopprettet fra sciencedirect.com.
- Malishev, B.W. (1936). Fosforpentoksid som raffineringsmiddel for bensin. Industriell og teknisk kjemi 1936, 28, 2, 190-193. Gjenopprettet fra pubs.acs.org.
- Epps, Jr. E.A. (1950). Fotometrisk bestemmelse av tilgjengelig fosforpentoksid i gjødsel. Analytisk kjemi 1950, 22, 8, 1062-1063. Gjenopprettet fra pubs.acs.org.
- Banerjee, A. et al. (1983). Bruk av fosforpentoksid: forestring av organiske syrer. J. Org. Chem. 1983, 48, 3108-3109. Gjenopprettet fra pubs.acs.org.
- Cotton, F. Albert og Wilkinson, Geoffrey. (1980). Avansert uorganisk kjemi. Fjerde utgave. John Wiley & Sons.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology. Fjerde utgave. John Wiley & Sons.
- Ogliari, F.A. et al. (2008). Syntese av fosfatmonomerer og binding til dentin: Forestringsmetoder og bruk av fosforpentoksid. Journal of Dentistry, bind 36, utgave 3, mars 2008, side 171-177. Gjenopprettet fra sciencedirect.com.



Ingen har kommentert denne artikkelen ennå.